メチルリチウム (methyllithium) は化学式 CH3Li で表される有機リチウム化合物である。メチル基を Me と略記し、MeLi とも表記される。溶液中および固体状態では会合体(クラスター)を形成している。反応性が非常に高く、炭化水素溶液やエーテル溶液として有機合成などに用いられる。水や酸素に弱いため、無水・無酸素条件下で取り扱う必要がある。普通は実験室で調製されることはなく、溶液が広く市販されている。
合成
直接法では、ブロモメタンをジエチルエーテル中にけん濁した金属リチウムと反応させることによって合成される。
副生する臭化リチウムはメチルリチウムと錯体を形成するため、通常、メチルリチウムはこの錯体として存在する。ハライドを含まないメチルリチウムが必要な場合にはクロロメタンから合成したものが利用される。塩化リチウムはメチルリチウムとほとんど錯形成せず、エーテル溶媒中では沈殿するので、ろ過して除去すれば純粋なメチルリチウムが得られる。
反応
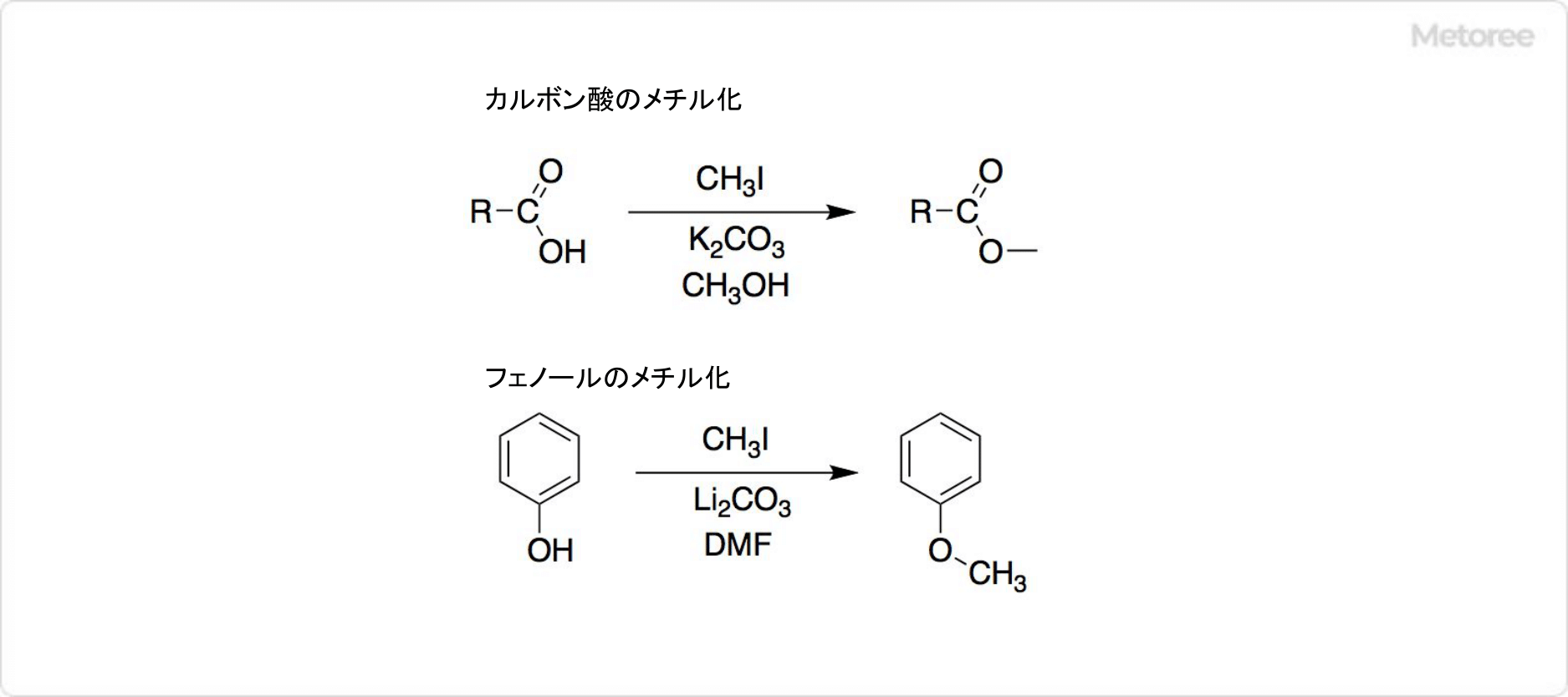
強塩基であると同時に求核性も高い。炭素原子は形式的に負電荷を持ち、求電子剤やプロトン供与剤と反応する。主にメチル化剤、リチオ化剤として使われる。
例えばフェロセンはメチルリチウムで処理するとリチオ化される。有機化学などで溶媒として用いられるテトラヒドロフランとも反応する。水やアルコールとは激しく反応する。メチルリチウムを使った反応は多くの場合大きく発熱的なため、低温で行う必要がある。
メチルリチウムはメチルアニオン等価体として用いられる。ケトンと反応させるとメチル化し、中間体を加水分解すると三級アルコールが得られる。
非金属ハロゲン化物に作用させるとメチル基が導入された生成物を与える。三塩化リンとの反応を例示する。
一般的に上記の目的には、より安全に取り扱うことができ、同等の反応性を有するメチルマグネシウムハライドが用いられる。
メチル基を持つ遷移金属錯体はメチルリチウムを使って合成することができる。
構造
単結晶のX線結晶構造解析および6Li、7Li、13CのNMR分光法から、2種類の構造が確認されている。ひとつはゆがんだキュバンのような形を持つ四量体クラスターで、炭素原子とリチウム原子はそれぞれ立方体の頂点に位置する。Li−Li間の距離は2.68 Åであり、これは気相中のLi2分子における距離とほぼ等しい。C−Li間の距離は2.31 Åである。炭素原子はそれぞれ3つの水素原子、3つのリチウム原子と結合している。(CH3Li)4 には揮発性がなく、炭化水素溶媒に不溶であるが、これはクラスター間のアゴスティック相互作用によるものである。よりかさ高いtert-ブチルリチウムの四量体 (tert-C4H9Li)4 の場合、立体反発によってクラスター間の相互作用が抑えられるため、揮発性・溶解性を持つ。
もうひとつは六量体で、LiとCがそれぞれ交互に頂点に配置された、ゆがんだ六面体型のクラスターである。
どちらのクラスターが生成しやすいかは溶媒や添加剤(臭化リチウムなど)の有無によって決まる。ベンゼンなどの炭化水素溶媒中では六量体が、エーテル溶媒中では四量体が得られやすい。
結合
上記のクラスターはオクテット則を満たさない原子を含む、電子不足な化合物である。つまり一般的な有機化合物に見られる2中心2電子結合を形成するのに十分な電子を持っていない。六量体には30個の電子(価電子)があるが、そのうち18個はC−H結合に使われ、のこり12個がクラスター形成に使われる。リチウム−リチウム結合に6個の電子が割り当てられ、6個のメチル基はおのおの1個ずつの電子によってη3型の結合をリチウム原子と形成する。
IR測定からC−Li結合のエネルギーは57 kcal/molと見積もられている。
参考文献
関連項目
- n-ブチルリチウム
- sec-ブチルリチウム
- tert-ブチルリチウム